![]()
![]()
Les électrons dans l'atome
Les propriétés chimiques des atomes dépendent des électrons qu'ils contiennent, tout particulièrement de ceux situés sur la couche externe.
Structure électronique d'un atome :
Un atome possède Z électrons (Z=le n°atomique), répartis en couches (niveaux d'énergie), notées 1,2,3... ou K,L,M...
Chaque couche peut contenir un nombre maximum de 2n² électrons (n=n° de la couche), soit 2 pour la première, 8 pour la seconde, etc... Les couches sont elles mêmes divisées en plusieurs sous-couches.
Voici quelques exemples de formules électroniques d'atomes :
| H | He | C | N | O | Ne | Cl |
| (K)1 | (K)2 | (K)2(L)5 | (K)2(K)6 | (K)2(L)8 | (K)2(L)8(M)7 |
Représentation de Lewis d'un atome :
Elle donne une représentation des atomes, sous forme de doublets électroniques | ou d'électrons célibataires .

![]()
Molécules et ions
Régle de l'octet
Les atomes tendent à acquérir la structure électronique d'un gaz rare (qui ont une grande stabilité chimique : He, Ne, Ar...)
Cela peut être réalisé de plusieurs façons :
| gain d'un ou plusieurs électrons (formation d'un ion négatif monoatomique ex Cl-) | |
| perte d'un ou plusieurs électrons (formation d'un ion positif monoatomique ex Na+) | |
| établissement de liaisons de covalence conduisant soit |
| à des molécules par ex NH3 | |
| à des ions polyatomiques par exemple NO3- |
Voici, par exemple, la structure de Lewis des ions O2- et Cl-:
 C'est bien la structure d'un gaz rare (couche
externe saturée)
C'est bien la structure d'un gaz rare (couche
externe saturée)
La liaison de covalence
Quand deux atomes s'unissent par une liaison de covalence, chacun apporte un e-, et les deux électrons sont "mis en commun" entre les deux atomes. Par ce mécanisme, tout se passe comme si chaque atome avait un e- de plus sur sa couche externe.
Ce mécanisme se répète jusqu'à ce l'atome acquière la structure électronique d'un gaz rare ; cela explique que :
| l'hydrogène H établisse 1 liaison (il est monovalent) | |
| de même pour le chlore Cl ou l'iode I | |
| l'oxygène O est divalent | |
| l'azote N est trivalent | |
| le carbone C est tétravalent |
Voici la représentation de Lewis de quelques molécules :
| Le dihydrogène, avec un doublet liant entre
les deux atomes : | |
| Le chlorure d'hydrogène : |
| La molécule d'eau, dans laquelle l'atome d'oxygène est entouré de deux doublets liants et de deux doublets non
liants : |
La molécule d'ammoniac, avec l'atome d'azote trivalent et porteur également d'un doublet
d'électrons libres
: 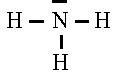 | |
| La molécule de méthane, dans laquelle on voit bien le carbone tétravalent : |
Tous les atomes précédents sont entourés de 4 paires d'électrons, sauf l'hydrogène qui n'a besoin que de 2 e- pour avoir la structure de l'hélium, gaz rare qui le suit dans la classification périodique
Insuffisance du modèle de Lewis
Le modèle de Lewis n'est pas suffisant pour prévoir la forme des molécules, qui est pourtant reliée à la structure électronique des atomes.
![]()
La méthode VSEPR
(Valence Shell Electron Pair Repulsion, c'est à dire : répulsion des paires d'électrons de la couche de valence, théorie due à Ronald Gillespie)
Principe de la méthode : On s'occupe de la forme de la molécule autour d'un atome donné
On compte le nombre de directions de l'espace contenant soit des doublets liants, soit des doublets non liants ; la forme de la molécule, autour de l'atome considéré, est la plus symétrique qui soit, en fonction de ce nombre.
Il y a alors trois cas :
| deux directions de liaisons seulement : la molécule est linéaire | |
| trois directions : la molécule est plane, triangulaire | |
| quatre directions : la forme de base est tétraédrique |
Exemples de molécules ou d'ions polyatomiques :
Les différents types de molécules sont notés
| AXnEm |
| A représente l'atome central | |
| X représente les directions, au nombre de n, comportant des doublets de liaison | |
| E représente les directions, au nombre de m, comportant des doublets non liants | |
| n+m représente donc le nombre total de directions à prendre en compte, et détermine la forme de base de la molécule autour de A |
1er cas n+m=4 : la forme dérive d'un tétraèdre
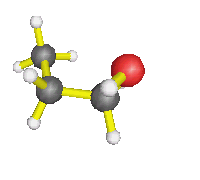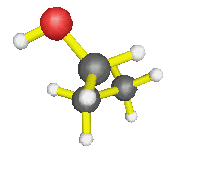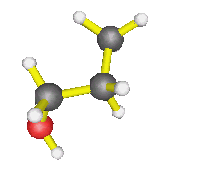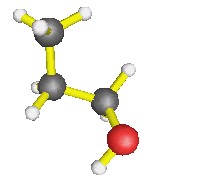
AX4 : molécules de méthane, éthane... d'une façon générale, autour d'un carbone où il n'y a que des simples liaisons, mais également l'ion ammonium : la forme est alors tétraèdrique |
| AX3E : molécule d'ammoniac, de méthanamine, d'éthanamide, d'une façon générale, autour d'un azote où il n'y a que des simples liaisons, mais également ion hydronium... : la forme est alors celle d'une pyramide à base triangulaire | |
| AX2E2 : molécule d'eau, d'une façon générale, autour d'un oxygène où il n'y a que des simples liaisons (dans l'éthanol par exemple) : la molécule est coudée |
2ième cas : n+m=3 AX3 la molécule est plane, triangulaire, avec des angles de120°
3ième cas : n+m=2 AX2 la molécule est linéaire (angle de 180°)
![]()