

Facteurs cinétiques
![]()
Température :
En règle générale, la vitesse d'une réaction augmente quand la température augmente |
traduction graphique sur l'exemple :
H2O2 + 2H+ + 2I- 2H2O + I2 |
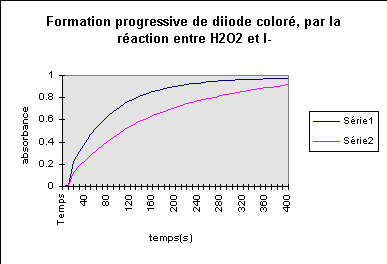
Dans cet exemple, la série 1 correspond à une température plus élevée que la série 2, les concentrations des réactifs étant les mêmes :
au début, la réaction est plus rapide dans (1) que dans (2) (ce n'est plus vrai au delà de 140s environ) ; à la fin de la réaction, la quantité de produit est la même.
Applications :
- la " trempe " d'une réaction (brusque refroidissement), permet de la stopper quasiment |
|
- dans la vie courante, les réactions qui dégradent les aliments sont ralenties au réfrigérateur, et encore plus dans un congélateur.Inversement, l'utilisation d'un autocuiseur augmente la vitesse de cuisson des aliments par augmentation de la température de cuisson |
|
- dans l'industrie, il est essentiel d' accroître la vitesse des réactions : le chauffage y contribue |
![]()
Concentration des réactifs :
En règle générale, la vitesse d'une réaction augmente quand la concentration d'un réactif augmente |
voir TP
Rqe : ce facteur est à l'origine de la forme habituelle d'une courbe de cinétique
 |
v3<v2<v1 car la concentration des réactifs décroit au fur et à mesure que la réaction se fait |
Catalyse :
C'est un facteur cinétique important ( Catalyse)
![]()